
本制品是一种非常便捷的用于酿酒酵母、毕赤酵母等菌株在质粒转化后阳性克隆菌落的PCR筛选和鉴定的试剂盒。本试剂盒提供了Yeast Lysis Enzyme用于消化酵母细胞壁,并提供了2×Yeast Colony PCR Mix(Green)用于进行PCR扩增。2×Yeast Colony PCR Mix(Green)是含有蓝色和橙色染料(电泳位置分别约4kb和50bp)的2倍浓度的PCR预混液,含有2×Taq DNA Polymerase、2×PCR Buffer、2×dNTP和2×Loading Buffer等,用户只需加入酵母菌落裂解液、引物和水即可进行PCR扩增,并且扩增完毕后可以直接上样电泳。
本试剂盒提供了Yeast Lysis Enzyme在PCR反应前对酵母进行有效预处理,可以充分降解酵母细胞壁并释放酵母DNA,能确保有效进行酵母菌落PCR,从而大大缩短酵母转化后阳性克隆鉴定的时间,提高实验效率。

酵母是一种经典的真菌模式生物,被广泛用于细胞生物学、遗传学、衰老等方面的研究。同时酵母作为真核生物具有较快的生长速度、成熟的翻译后修饰系统和抗性筛选系统,在分子生物学研究中常常被用作动植物蛋白表达和互作的异源宿主检测系统。在酵母中进行基因操作时,为确保其准确性,需对DNA片段的引入或删除进行鉴定,常规步骤包括单菌落扩增培养、收集并裂解细胞、提取高纯度DNA模板及PCR检测,在进行大规模筛选工作时,该方法往往成本高且效率低。菌落PCR无需预先分离或纯化DNA,而是直接以菌体或菌体裂解液为模板来完成靶标序列的扩增,相对而言比较快速高效。
酵母细胞的细胞壁主要成分为多糖(85%~90%)和蛋白质(10%~15%),其中多糖是由甘露聚糖、β-葡聚糖和少量的几丁质等组成,处于细胞壁内层的β-葡聚糖与几丁质共价相连,起到细胞骨架的作用;而外层的甘露聚糖与中层蛋白质中的丝氨酸或苏氨酸以O-糖苷键相连接,形成的甘露糖蛋白覆盖于细胞表面,给予酵母细胞一定的韧性。酵母细胞壁独特的结构致使其DNA难以被简单的PCR加热过程所释放,导致很多将酵母直接作为模板进行PCR检测的试剂盒成功率都比较低。

- 本试剂盒使用非常便捷。本试剂盒中提供的2×Yeast Colony PCR Mix(Green)已经含有所有的通用组分,用户只需自备引物和水即可对酵母菌落进行PCR扩增。它大大简化了PCR操作,使操作更加快捷,也减少了PCR操作过程中可能导致的污染,使PCR的重复性更好;同时2×Yeast Colony PCR Mix(Green)中已经包含了上样缓冲液组分,PCR扩增结束后即可直接上样电泳,无需添加上样缓冲液。
- 本试剂盒中提供了双色染料,便于电泳时观察电泳进程。本试剂盒中的2×Yeast Colony PCR Mix(Green)加入了蓝色和橙色的电泳示踪染料(整体呈现绿色),其在浓度为1%琼脂糖胶中的迁移位置分别大约位于4kb和50bp处。PCR结束后可直接进行电泳检测,无需再添加上样缓冲液。蓝色和橙色示踪染料不会影响对相应DNA条带的观察和检测。
- 本制品稳定性高。经测试,本试剂盒中的PCR mix反复冻融15次后对PCR的扩增效果无显著影响。

| 组分 | 100T | 500T |
| Yeast Lysis Enzyme | 1管 | 2管 |
| Enzyme Preparation Solution | 500μL | 2mL |
| Enzyme Reaction Buffer | 2mL | 10mL |
| 2×Yeast Colony PCR Mix(Green) | 1mL | 1mL×5 |
保存:-20℃,有效期1年。

- Enzyme Preparation Solution和Enzyme Reaction Buffer可以室温或4℃保存。Yeast Lysis Enzyme配制成溶液后4℃可以保存1个月,-20℃可以保存6个月。
- 酵母菌落较难裂解,裂解时请注意吹打混匀或Vortex震荡混匀。
- 由于PCR反应非常灵敏,可使目的基因扩增超过1000万倍,在设置PCR反应时请注意避免微量待扩增DNA的污染,并尽量考虑设置不加模板的空白对照以确认是否有待扩增DNA的污染。
- 尽管本制品中的PCR mix经过15次反复冻融后仍具有和冻融前几乎相同的PCR扩增效果,但仍宜适当避免反复冻融本制品,多次反复冻融可能使产品性能下降。
- 使用本制品前,一定要完全融化,并上下颠倒轻轻混匀后才能使用,并尽量避免产生气泡。
- 超纯水推荐选购无菌无酶超纯水(货号:YT998)。

- 使用本试剂盒对毕赤酵母菌落检测效果请参考图1。
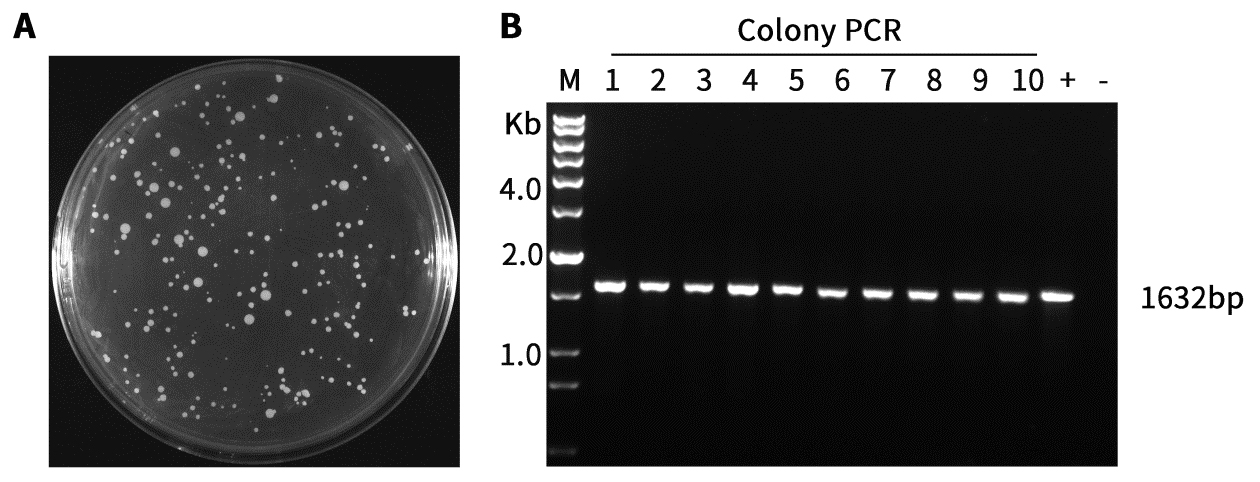
图1.本试剂盒对于毕赤酵母菌落的检测效果图。
A.使用毕赤酵母感受态细胞制备及转化试剂盒制备的毕赤酵母KM71感受态细胞转化带有目的基因的pAOX1-α factor-MCS-His-Zeocin载体培养72小时的平板。
B.图A中的菌落使用本试剂盒进行菌落PCR后的电泳图。用无菌吸头挑取0.2~1mm酵母单克隆菌落至含24μL Yeast Lysis Enzyme溶液的PCR八联排管(0.2mL,凸盖,透明)中,混匀,随后在PCR仪或水浴中30℃孵育30分钟,紧接着在PCR仪上95℃加热10分钟以失活Yeast Lysis Enzyme,随后取3μL酶消化后的菌液作为PCR模板,进行菌落PCR检测。PCR反应条件:94℃ 3分钟;94℃ 30秒,55℃ 30秒,72℃ 1分30秒,30个循环;72℃ 10分钟,4℃ forever。1632bp是目的基因片段的扩增条带。M,DNA Ladder(200bp~12kb)。1-10,实验组(PCR模板为酵母单菌落裂解后的菌液);+,阳性对照;-,阴性对照。本制品的实际使用效果会因实验条件、实验材料等的不同而存在差异,图中效果仅供参考。 - 使用本试剂盒对酿酒酵母菌落检测效果请参考图2。
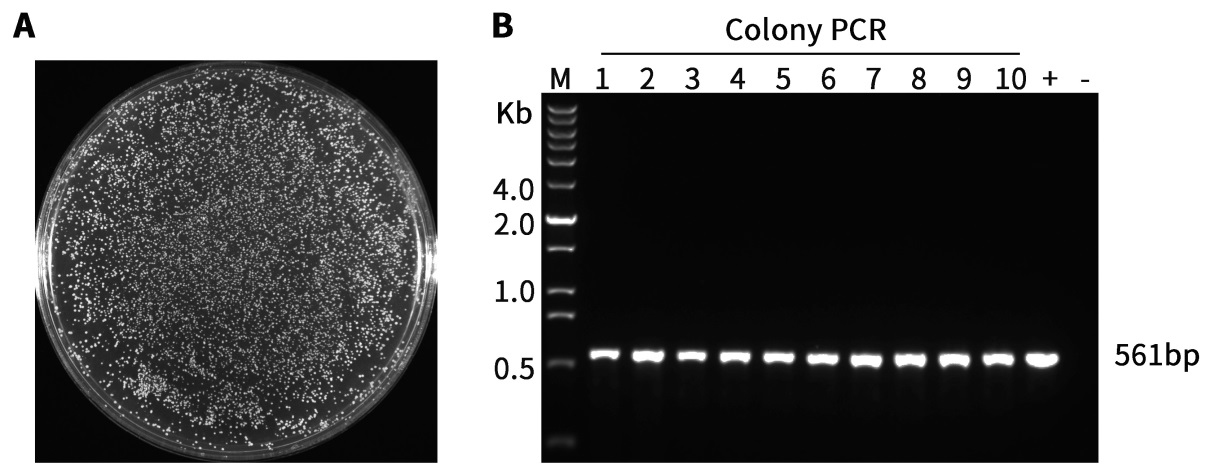
图2.本试剂盒对于酿酒酵母菌落的检测效果图。
A.酿酒酵母INVSc1感受态细胞转化pGAL1,10-α factor-His-Flag-URA载体培养48小时的平板。
B.图A中的菌落使用本试剂盒进行菌落PCR后的电泳图。用无菌吸头挑取0.2~1mm酵母单克隆菌落至含24μL Yeast Lysis Enzyme溶液的PCR八联排管(0.2mL,凸盖,透明)中,混匀,随后在PCR仪或水浴中30℃孵育30分钟,紧接着在PCR仪上95℃加热10分钟以失活Yeast Lysis Enzyme,随后取3μL酶消化后的菌液作为PCR模板,进行菌落PCR检测。PCR反应条件:94℃ 3分钟;94℃ 30秒,55℃ 30秒,72℃ 40秒,30个循环;72℃ 10分钟,4℃ forever。561bp是目的基因片段的扩增条带。M,DNA Ladder(200bp~12kb)。1-10,实验组(PCR模板为酵母单菌落裂解后的菌液),+,阳性对照;-,阴性对照。本制品的实际使用效果会因实验条件、实验材料等的不同而存在差异,图中效果仅供参考。

- Yeast Lysis Enzyme溶液的配制:
对于小包装试剂盒吸取400μL Enzyme Preparation Solution至一管粉末中;对于中包装试剂盒吸取1mL Enzyme Preparation Solution至一管粉末中。充分溶解,即配制成Yeast Lysis Enzyme溶液。Yeast Lysis Enzyme溶液,4℃可以保存1个月,-20℃可以保存6个月。 - 酵母菌落的裂解:
- 准备PCR管,每管中加入20μL Enzyme Reaction Buffer和4μL Yeast Lysis Enzyme溶液。可以把20μL Enzyme Reaction Buffer和4μL Yeast Lysis Enzyme溶液预先混合(称为Yeast Lysis Enzyme反应液)。如需-20℃保存,请先适当分装。Yeast Lysis Enzyme溶液配制后或冻存后再溶解可能会出现轻微混浊,属正常现象,请混匀后使用。
- 用无菌吸头挑取0.2~1mm酵母单克隆至含24μL Yeast Lysis Enzyme反应液的PCR管中,吹打混匀或Vortex混匀,低速离心数秒使液体聚集在管底。同时对于该菌落进行标记或同时接种该菌落到液体培养基或新的平板上。
- 菌体过多可能会影响Yeast Lysis Buffer对酵母的裂解并影响后续PCR反应,菌体量通常不宜超过约2μL。
- 在PCR仪或水浴中30℃孵育30分钟,紧接着在PCR仪上95℃加热10分钟,以充分释放酵母的DNA。后续即可作为DNA模板用于PCR检测。
- 准备PCR管,每管中加入20μL Enzyme Reaction Buffer和4μL Yeast Lysis Enzyme溶液。可以把20μL Enzyme Reaction Buffer和4μL Yeast Lysis Enzyme溶液预先混合(称为Yeast Lysis Enzyme反应液)。如需-20℃保存,请先适当分装。Yeast Lysis Enzyme溶液配制后或冻存后再溶解可能会出现轻微混浊,属正常现象,请混匀后使用。
- 酵母菌落PCR反应体系的设置:
- 室温融解2×Yeast Colony PCR Mix(Green),上下颠倒轻轻混匀后低速离心数秒。
- 参考下表在冰浴上设置PCR反应体系:
成分 终浓度 用量 超纯水 - 5.4μL Primer mix (5μM each) 0.4μM each 1.6μL 2×Yeast Colony PCR Mix(Green) 1× 10μL 总体积 - 17μL - 通常引物的终浓度为0.2μM时可获得良好的检测效果,也可以根据情况在0.1~1.0μM范围内调整引物的终浓度。扩增效率不高的情况下,可提高引物的浓度;发生非特异性反应时,可降低引物浓度。超纯水可以选购无菌无酶超纯水。
- 吸取步骤2c准备好的DNA模板3μL至配制好的17μL PCR反应体系中,轻轻吹打混匀或轻微Vortex混匀,室温低速离心数秒,使液体聚集在管底。
- 如果所使用的PCR仪有热盖则省略本步骤。如果PCR仪没有热盖,则在管内滴入一滴矿物油。
- 把设置好的PCR反应管置于PCR仪上,开始PCR反应。
- 室温融解2×Yeast Colony PCR Mix(Green),上下颠倒轻轻混匀后低速离心数秒。
- PCR反应参数的设置可以参考如下示例:
STEP1(起始变性):94℃ 3min
STEP2(变性):94℃ 30sec
STEP3(退火):55℃ 30sec
STEP4(延伸):72℃ 1min/kb
STEP5(循环):Go To STEP2 for 30 cycles
STEP6(最终延伸):72℃ 10min
STEP7(临时保存):4℃ forever- PCR反应的设置需根据模板、引物、PCR产物的长度和GC含量等条件的不同,设定不同的PCR反应条件包括温度、时间和循环数等。
- STEP4(延伸)的时间设置需根据PCR产物的长度进行设置,通常每kb产物的延伸时间为1分钟。例如PCR产物的长度为1kb,则延伸时间可以设置为1分钟,PCR产物的长度为2kb,则延伸时间可以设置为2分钟,以此类推。
- 对于初次进行的PCR,为尽量确保可以扩增出预期的PCR产物,可以把循环数设置为35。对于需进行半定量或定量的PCR反应循环数一定要进行适当优化,使PCR反应没有达到平台期。
- PCR反应的设置需根据模板、引物、PCR产物的长度和GC含量等条件的不同,设定不同的PCR反应条件包括温度、时间和循环数等。
- 结果检测:PCR结束后直接取5~10μL进行电泳检测,无需添加上样缓冲液。

- PCR产物非常少或没有特异性条带。
- 引物设计不佳是PCR过程中最常见的问题。请选择适当的引物设计软件进行引物设计,注意引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在加入酶切位点等的引物中,一定要注意加入酶切位点等后整条引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在原有引物效果不佳的情况并且阳性对照引物可以正常工作的情况下,可以考虑更换引物。
- 待扩增片段GC含量偏高。GC含量较高的情况下PCR会变得相对比较困难,此时可以使用适合扩增高GC含量DNA片段的GC-rich buffer,并相应地根据GC-rich buffer的要求或说明调整PCR反应参数的设置。
- 长片段扩增。尽管Taq DNA polymerase可以扩增最长达8kb的DNA片段,但大多数时候比较适合扩增2~3kb以下的片段,更长片段的扩增推荐使用其它更适合长片段扩增的DNA聚合酶。
- PCR反应设置时在室温进行容易导致非特异性条件。推荐在冰浴上设置PCR反应。
- 由于引物存在一定的二级结构或存在一定的引物二聚体,或引物偏短,导致退火效果不佳。此时可以采用Touch down等方法进行退火,通常采用从65℃逐步缓慢降温到55℃或50℃的方法,使退火更加充分。
- 退火温度不佳,需要优化。如果有温度梯度PCR仪,则可以设置退火的温度梯度,摸索退火的最佳温度。如果没有温度梯度PCR仪,则可以通过多次PCR反应摸索最佳的退火温度。
- 延伸时间不足。可按照每1kb片段延伸1分钟进行设置,对于较难扩增的片段可以设置为每1kb片段延伸1.5~2分钟。
- 待扩增片段GC含量较高或长度较长,变性不够充分。可以调节起始变性条件至95℃ 1min甚至95℃ 2~4min。
- 在不同PCR仪上进行PCR反应,避免有时PCR仪出现问题。
- 循环数不足,适当延长PCR的循环数。通常循环数最高不必超过40,常用的循环数范围为25-35。
- 当产生较多非特异性条带时,可以适当提高退火温度。
- 注意设置适当的阳性对照和阴性对照通常会有很大帮助。
- 引物设计不佳是PCR过程中最常见的问题。请选择适当的引物设计软件进行引物设计,注意引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在加入酶切位点等的引物中,一定要注意加入酶切位点等后整条引物的GC含量、二级结构、二聚体、退火温度、长度、特异性等方面的问题。在原有引物效果不佳的情况并且阳性对照引物可以正常工作的情况下,可以考虑更换引物。
相关搜索:酵母菌落PCR筛选鉴定试剂盒(酶解法),酿酒酵母,毕赤酵母,阳性克隆菌落,Yeast Colony PCR Kit by Enzymatic Lysis



